Jika suatu zat A dilarutkan kedalam pelarut B sehingga zat A pecah menjadi bagian-bagian yang kecil, maka akan diperoleh suatu larutan. Peristiwa bercampurnya dua zat tersebut dinamakan sistem dispersi. Zat A disebut sistem terdispersi, sedangkan zat B sebagai dispergen ( medium pendispersi)
Berdasarkan dari besarnya ukuran partikel zat terdispersi (zat terlarut) maka sistem dispersi dapat dibedakan menjadi 3 macam , yaitu :
Dispersi Halus ( larutan sejati )
Disebut juga sebagai dispersi molekuler, yaitu sistem dispersi yang diameter fasa terdispersinya < 10-7 Cm. Sistem ini bersifat homogen dan tampak jernih. Pengendapan tidk akan terjadi sehingga dengan penyaringan zat terdispersi tidak dapat dipisahkan dari mediumnya, Contohnya : dispersi gula dalam air.
Dispersi Koloid ( larutan Koloid )
Sistem dispersi yang diamter fasa terdispersinya antara 10-7 – 10-5 Cm. Sifat-sifatnya terletak diantara suspensi dan larutan sejati, tidak bersifat homogen ataupun heterogen. Sistem ini senantiasa keruh dan tidak terjai pengendapan sebagai penyaringan fasa terdispersi tidak dapat dilakukan. Contoh : dispersi susu dalam air.
Dispersi kasar (Suspensi )
Sistem dispersi yang diameternya >10-5 Cm. Sistem ini mula-mula keruh tetapi dalam beberapa saat segera tampak jelas batas antara fasa terdispersi dengan medium pendispersinya. Karena terjadi pengendapan maka dengan cara penyaringan dapat dipisahkan kembali fasa terdispersi dari mediumnya. Contoh : dispersi pasir dalam air.
Jika suatu larutan tersusun dari komponen-komponen zat terlarut dan zat pelarut, maka suatu sistem koloid juga tersusun dari dua komponen, yaitu fasa terdispersi (zat terlarut) dan medium endispersi (pelarut).
Dalam sistem koloid, baik fasa terdispersi maupun medium pendispersinya dapat berupa gas, cair ataupun padat, oleh karena itu dikenal 8 macam sistem koloid yang secara legkap dapat dilihat pada tabel macam-macam sistem koloid. Sisitem koloid fasa terdispersi gas dan medium pendispersi gas tidak ada dikarenakan campuran antara gas dengan gas selalu menghasilkan campuran yang bersifat homogen, partikel-partikel gas berukuran molekul atau ion ( diameter < 10-7 Cm) dan jarak antar partikel gas tersebut sangat renggang.
Campuran : dua jenis zat atau lebih yang dicampurkan menjadi satu
Campuran terdiri dari zat pelarut dan zat terlarut,
Campuran dibedakan menjadi
Campuran Homogen yang disebut larutan
Campuran Heterogen yang di sebut suspensi
SISTEM KOLOID
Sistem Koloid : sistem campuran yang mempunyai sifat diantara larutan dan suspensi.
Dalam kehidupan sehari – hari disekeliling kita dapat ditemukan zat yang tergolong larutan koloid dan suspensi
Contoh Larutan : Larutan gula, larutan garam, alkohol , asam cuka
Contoh Koloid : Air susu, santan, getah karet, asap, mentega
Contoh Suspensi : air yang keruh, air kapur, tanah liat dengan pasir.
Perbedaan larutan, koloid dan suspensi
| NO | Larutan | Koloid | Suspensi |
| 1 | Diameter partikel < 10-7 Cm | Diameter partikel 10-7 – 10-5 Cm | Diameter partikel > 10-5 Cm |
| 2 | Homogen | Antara homogen dan heterogen | Heterogen |
| 3 | Satu fase | Dua fase | Dua fase |
| 4 | Jernih | Keruh | keruh |
| 5 | Jika didiamkan tidak memisah | Jika didiamkan tidak memisah | Jika didiamkan tidak memisah |
| 6 | Tidak dapat disaring tapi lolos dalam membran semi permeabel | Dapat lolos dalam membran semi permeabel | Dapat disaring dan tidak lolos dalam membran semi permea |
Membran semipermeabel adalah membran yang dapat dilalui oleh pelarut, tetapi tidak dapat dilalui oleh zat terlarut.
MACAM-MACAM KOLOID
Berdasarkan fase zat ( padat, cair dan gas ) , terdapat 8 macam sistem koloid
Fase Terdispersi dan medium pendispersi
| No | Fase Tredispersi | Fase Pendispersi | Nama Koloid | Contoh |
| 8 | Gas | Cair | Busa/ buih | Busa sabun, buih |
| 7 | Gas | Padat | Busa padat | Batu apung, karet busa |
| 6 | Cair | Gas | Aerosol Cair | Kabut,awan |
| 5 | Cair | Cair | Emulsi | Susu, minyak ikan |
| 4 | Cair | Padat | Emulsi padat | Mentega, keju, mutiara |
| 3 | padat | Gas | Aerosol padat | Asap, debu |
| 2 | Padat | Cair | Sol | Cat, kanji, tinta |
| 1 | Padat | Padat | Sol padat | Paduan logam, kaca berwarna |
Gas dengan gas tidak membentuk sistem-sistem koloid sebab gas dengan gas membentuk campuran homogen
Pengertian macam-macam sistem koloid
Busa/buih : Sistem koloid yang fase terdispersinya gas dan medium pendispersinya cair.
Busa padat : Sistem koloid yang terjadi jika fase padat terdispersi dalam medium pendispersi gas.
Aerosol Cair : Sistem koloid dengan fase terdispersi cair dalam medium pendispersi gas
Emulsi : Sistem dispersi antara cairan dengan cairan yang tidak dapat bercampur homogen
Emulsi padat : Sistem koloid dengan fase terdispersi cair dalam medium pendisfersi padat yang tidak dapat bercampur.
Aerosol padat : Dispersi partikel-partikel padat yang sangat halus dalam medium gas
Sol padat : sistem koloid dengan fase terdispersi padat dalam medium pendispersi padat.
Sol : Sistem koloid dimana zat padat terdispersi dalam zat cair, berdasarkan sifat absorpsi zat padat terhadap cairan pendispersi.
Ada 2 macam sol yaitu :
- Sol Liofil : Jika partikel-partikel padat mengabsorpsi cairan pendispersi, sistem ini bersifat kental dan tidak mengalami koagulasi jika didalamnya ditambahkan larutan elektrolit.
- Sol Liofob : Jika partikel padat tidak menjadi absorpsi molekul cairan. Sistem ini mudah menggumpal jika ditambahkan larutan elektrolit.
Jika medium pendispersinya masing-masing air, maka liofil dan liofob dinamakan hidrofil dan hidrofob.
Tabel —– Perbedaan Sol Liofil dan sol Liofob
| No | Sol Liofob | Sol Liofil |
| 1 | Bersifat kurang stabil | Bersifat stabil |
| 2 | Terdiri atas zat organik | Terdiri atas zat organik |
| 3 | Kekentalannya rendah | Kekentalannya tinggi |
| 4 | Untuk koagulasi memerlukan sedikit elektrolit | Untuk koagulasi memerlukan banyak elektrolit |
| 5 | Gerak Brown sangat jelas | Gerak Brown kurang jelas |
| 6 | Hanya dibuat dengan cara kondensasi | Umumnya dibuat dengan cara dispersi |
| 7 | Partikel terdispersi mengadsorpsi ion | Partikel terdispersi mengadsorpsi molekul |
| 8 | Reaksinya Irreversibel | Reaksinya reversibel |
| 9 | Bermuatan listrik tertentu | Muatan listrik tergantung pada medium |
Kegunaan Koloid
Sistem koloid banyak digunakan dalam bidang industri, karena koloid merupakan suatu cara untuk memperoleh campuran hasil industri, saling melarutkan dan sifatnya stabil. Dalam kenyataan banyak produk industri yang berupa sistem koloid baik sebagai bahan makanan, bangunan dan obat-obatan
Bidang makanan : susu, margarine, krim, jeli, agar-agar dll
Bidang bangunan : Cat tembok, cat kayu, lem ( lem kaca, kayu dan plastik )
Bidang obat-obatan : Kapsul,
Kosmetik
Bahan – bahan kosmetik pada umumnya hampir 90% disebut bahan kolid hal itu disebebkan koloid mudah menyerap pewangi, pewarna. Lembut mudah dibersihkan serta tidak merusak kulit dan rambut.
Macam-macam bahan kosmetik
Berupa sol padat : Lisptik, pensil alis, dan maskara
Berupa emulsi : Susu pembersih muka/kulit
Berupa sol : Cairan masker dan cat kuku
Berupa gel : deodorant, minyak rambut ( jelly)
Berupa Aerosol : Spray parfum, deodorant, hairspray
Berupa Buih : Sabun kecantikan
SIFAT – SIFAT KOLOID
Sifat – sifat sistem koloid dapat dikelompokkan menjadi 4 macam yaitu :
Sifat yang berhubungan dengan optik
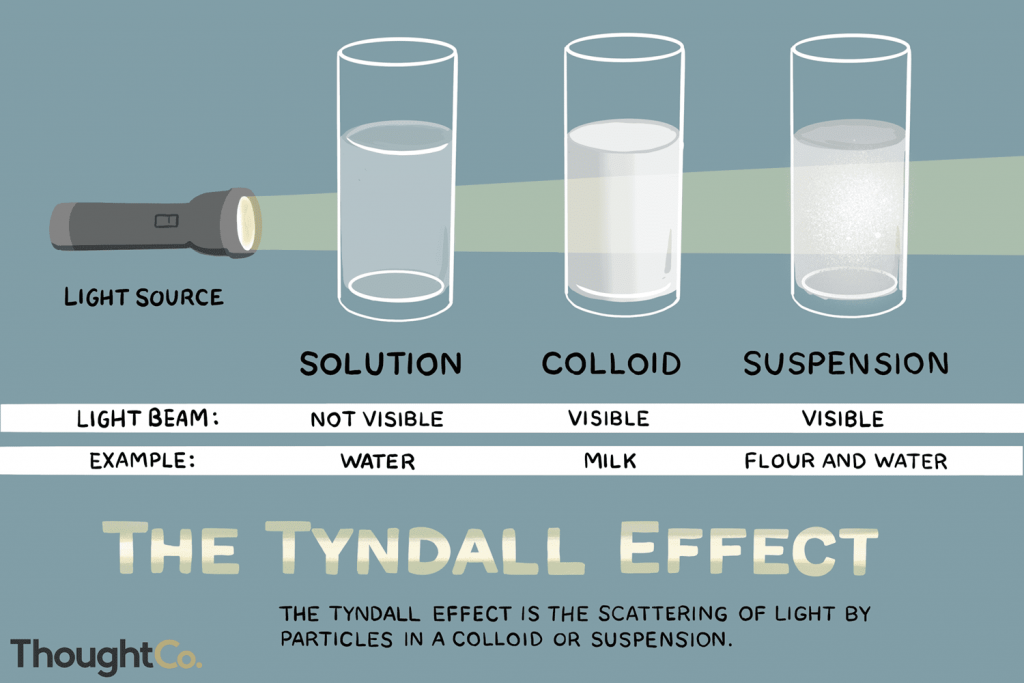
a. Efek Tyndall
Adalah penghamburan berkas cahaya oleh dalam sistem koloid. Pertama kali dikemukakan oleh seorang ilmuwan Inggeris bernama Jhon Tyndall ( 1820-1893). Contoh efek Tyndall
Langit berwarna biru karena penghamburan cahaya oleh partikel-partikel hidrogen dan oksigen dalam udara.
Berkas cahaya akan berdampak jelas jika memasuki ruang gelap melalui suatu celah karena terjadinya penghamburan oleh partikel –partikel itu dalam udara
Berkas cahaya jika dilewatkan dalam sistem koloid akan terlihat jelas terjadi penghamburan, sedang jika dilewatkan dalam suatu larutan itu tak terlihat sebab partikel-partikel dalam larutan terlalu kecil untuk memantulkan cahaya.
Partikel debu ( sebagai koloid) seolah-olah bercampur pada tempat yang sinar yang berasal dari celah-celah dinding.
b. Gerak Brown
Gerak partikel- partikel dalam sistem koloid yang terus menerus dengan arah zig zag (random ). Karena terjadi tumbukan antar partikel. Hal ini pertama kali diamati oleh Robert Brown pada tahun 1827. Gerak brown dapat diamati oleh miksroskop .
Sifat yang berhubungan dengan gejala permukaan
Adsorpsi Koloid
Yaitu peristiwa melekatnya partikel zat (ion, atom atau molekul ) pada permukaan suatu zat lain. Jika penyerapan itu sampai ke dalam ( dibawah permukaan ) istilahnya adalah Absorpsi.
Sifat yang berhubungan dengan kelistrikan
Koagulasi
Yaitu peristiwa penggumpalan ( pengendapan partikel-partikel koloid jika ke dalam sistem itu ditambahkan suatu elektrolit. Koagulasi biasa digunakan untuk menjernihkan air sungai.
Elektroforesis
Yaitu berpengaruhnya partikel-partikel koloid oleh medan listrik. Partikel koloid yang bermuatan posistif akan bergerak ke elektroda negatif dan sebaliknya. Pada peristiwa ini partikel koloid akan ternetralkan dan menggumpalkan elektroda.
Dialisis
Yaitu cara membersihkan partikel-partikel koloid dari ion-ion yang mengganggu kestabilan koloid. Koloid dimasukkan dalam kantong semipermeabel, kemudian kantong tersebut dicelupkan ke dalam air yang mengalir. Ion-ion pengganggu akan hanyut oleh air sedangkan partikel koloid tetap berada dalam kantong.
Sifat lain yang penting
Opalesensi
Yaitu sifat koloid dimana koloid pada sinar datang tidak sama dengan sinar pergi
Sifat kologatif yang tidak jelas
Yaitu sifat yang hanya bergantung pada banyaknya partikel zat terlarut, tetapi tidak bergantung pada jenisnya.
Penggunaan sistem adsopsi
a. Penjernihan air keruh dengan menggunakan tawas Kal(SO4)2 24 H2O
b. Penjernihan gula tebu dengan menggunakan karbon aktif
c. Pengobatan sakit perut dengan menggunakan tablet Norit
c. Muatan Koloid
Karena koloid mempunyai sifat adsorpsi maka koloid dapat bermuatan, bermuatan positif jika koloid yang diadsorpsi ion positif ( kation ) bermuatan negatif jika diadsorpsi ion negatif ( Anion)
d. Koagulasi /Pengendapan/penggumpalan
Koagulasi dapat terbentuk jika
a. Koloid bermuatan positif (+) bercampur dengan koloid bermuatan negatif (-)
b. Koloid bermuatan positif menyerap ion negatif
c. Koloid bermuatan negatif menyerap ion positif
Contoh koagulasi
a. Pembentukan delta dimuara sungai sebab air sungai yang mengandung lumpur dengan air laut yang melarutkan garam-garam sebagai elektrolit
b. Penggumpalan asap pabrik dengan menggunakan alat katrel yang hubungkan dengan arus listrik
c. Penggumpalan getah karet jika ditambahkan asam cuka
Semakin tinggi konsentrasi zat elektrolit koagulasi semakin cepat
e. Dialisis
Proses pemisahan koloid dari ion-ion mengganggu dengan menggunakan selaput semi permeabel yang di dapatkan dalam air.
f. Elektroforesis
Peristiwa pemisahan sistem koloid yang bermuatan dengan menggunakan arus listrik
Koloid yang menuju kutub positif menunjukkan kutub bermuatan negatif sebaliknya koloid yang menuju kutub negatif menunjukkan kutub bermuatan positif.
g. Koloid Pelindung
Koloid yang mempunyai kemampuan untuk melindungi koloid yang ada dibawahnya dari koagulasi.
Contoh : Lem bagian atasnya agak kering tetapi bagian bawahnya tidak
Pembuatan Koloid
Kondensasi
Pembentukan koloid dengan mengubah partikel – paryikel dari larutan sejati menjadi partikel- partikel koloid
a. Cara fisika : Pendinginan ( dapat dilakukan dengan menurunkan kelarutan suatu zat terlarut dengan cara mengubah pelarut atau dengan cara pendinginan, contohnya pembuatan sol belerang.
b. Cara Kimia :
· Reaksi hidrolisis
FeCl3(aq) + H2O(aq) —à Fe(OH)3(s) + HCl(aq)
Fe(NO3)3(aq) + H2O(aq) —à Fe(OH)3 (s) + HNO3(aq)
· Reaksi Redoks ( jika mengalami perubahan biloks)
Au3(aq)+ + Sn2+(aq) —–à Au+(s) + Sn4+(aq)
· Reaksi Pengenceran
AgNO3(aq) + HCl(aq) —à AgCl(s) + HNO3(aq)
AgOH(aq) + KCl(aq) —-à AgCl(s) + KOH(aq)
2H3AsO3 + 3 H2S —-à As2S3(s) + 6 H2O
Dispersi
Pembuatan dari suspensi dengan memperkecil ukuran partikel
a. Cara Mekanik : pembuatan koloid dengan menggunakan alat tertentu seperti blender
b. Cara busur bredig : pembuatan koloid logam dengan cara menjadikan logam sebagai elektroda dicelupkan dalam air yang dialiri arus listrik
c. Cara Peptisasi : Pembuatan koloid dengan menambahkan ion sejenis pada suatu endapan AgCl(s) + Ag+ —à AgCl(s)
AgCl(s) + NaCl(aq) ---à AgCl(s)Pemurnian Koloid
Biasanya koloid yang sudah terbentuk mengandung zat-zat pengotor, ini sangat mengganggu kestabilan koloid sehingga harus dihilangkan
Contoh : 2FeCl3 (aq) + 6H2O(aq) —à 2Fe(OH)3(s) + 6 HCl ( zat pengotor, dan harus dihilangkan )
Daftar Pustaka
Ahmad,Histia,1997, Kimia Larutan, Dept Kimia MIPA, ITB.
Sutarso,Tatang, Drs dan kawan-kawan, 1994, Kimia 2 Jakarta : Yudistira.
Depdikbud, 1994. GBPP kimia SMU, Jakarta
